Antwort Was sind Elektronenschiebende Substituenten? Weitere Antworten – Was ist ein Substituent in der Chemie
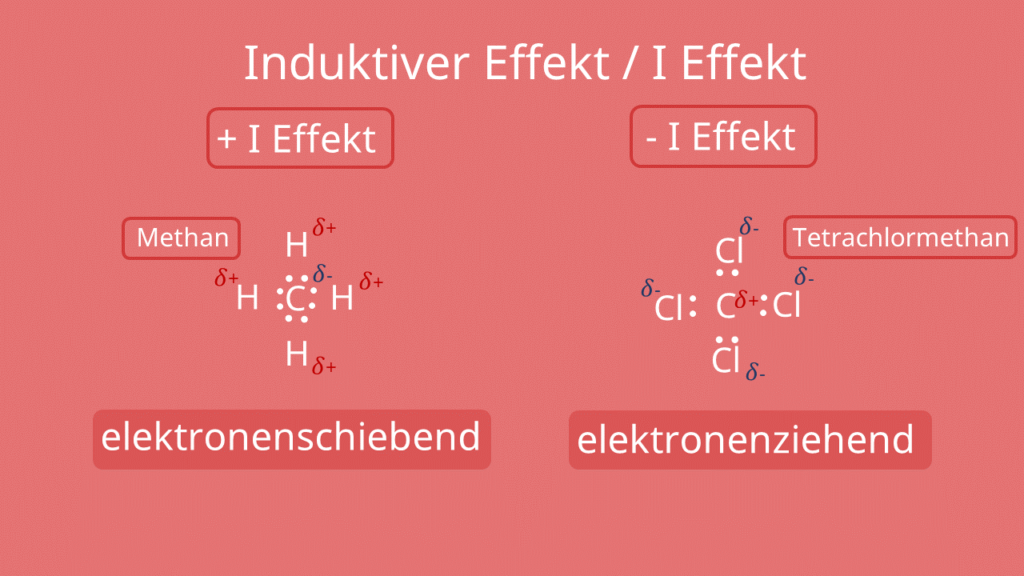
Als Substituenten (v. lat.: substituere = ersetzen) im engeren Sinne bezeichnet man in der Chemie Atome oder Atomgruppen in einem Molekül, die neu an der Stelle eines anderen Atoms eingefügt wurden und dieses somit ersetzen (substituieren).Der I-Effekt ist ein Begriff aus der organischen Chemie. Er wird durch die unterschiedliche Elektronegativität der Atome oder funktionellen Gruppen einer Kohlenstoffverbindung verursacht. Sie führt zu polaren Atombindungen und zu einer "Ladungsassymetrie".Da das Sauerstoff-Atom auf Grund seiner starken Elektronegativität einen elektronenziehenden Effekt (-I-Effekt) auf das Kohlenstoff-Atom ausübt, wird das Kohlenstoff-Atom positiv polarisiert, es erhält eine positive Partialladung.
Wann tritt der induktive Effekt auf : Wenn zwei Atome unterschiedliche Elektronegativitäten haben, führt dies zu einer ungleichen Verteilung von Elektronen entlang ihrer Bindung. Der induktive Effekt tritt auf, weil Elektronen von Atomen mit geringerer Elektronegativität zu Atomen mit höherer Elektronegativität verschoben werden.
Welche Substituenten gibt es
Man unterscheidet drei Arten von Substitutionsreaktionen:
- elektrophile Substitution (SE)
- nukleophile Substitution (SN1 und SN2)
- radikalische Substitution (SR)
Welche Substitutionen gibt es : Grundsätzlich sind zwei Substitutionsformen zu unterscheiden: befristete und unbefristete. Befristete Substitution wird auf 6 oder 12 Monate gewährt. Bei Zustimmung der Krankenkasse kann sie aber auch verlängert werden.
−I (negativer induktiver Effekt)
- Sauerstoff in der Carbonylgruppe –C=O.
- Hydroxygruppe –OH.
- Iodatom –I.
- Bromatom –Br.
- Chloratom –Cl.
- Nitrogruppe –NO2
- Aminogruppe –NH2
- Carboxygruppe –COOH.
Funktionelle Gruppen, die elektronschiebend wirken, weisen einen +I Effekt auf. Dies hat mehrere Ursachen. So wirken etwa negativ geladene Teilchen, oder welche mit einer geringen Elektronegativität auf diese Weise. Aber auch bei der Ausbildung von Hybridorbitalen ist dieser Effekt zu beobachten.
Warum zieht Sauerstoff Elektronen an
Das Sauerstoff-Atom ist deutlich elektronegativer als die Wasserstoff-Atome. Das bedeutet, dass das Sauerstoff-Atom die gemeinsamen Bindungselektronen stärker zu sich hinzieht als die Wasserstoff-Atome. Somit kommt es am Sauerstoff-Atom zu einem Überschuss an Elektronen.Die Wasserstoffatome besitzen mit der einen Bindung bereits je zwei Elektronen – hier sind wir also fertig. Das Sauerstoffatom hat bisher mit den beiden Bindungen nur vier Elektronen, es fehlen also nochmal vier. Daher teilen wir die beiden freien Elektronenpaare dem Sauerstoff zu.Induktiver Effekt
Die an ein Atom gebundenen Substituenten können das bindende Elektronenpaar unterschiedlich stark anziehen, wodurch die Bindung unterschiedlich stark polarisiert wird. Diese Polarisierung der Bindung durch den Substituenten bezeichnet man als induktiven Effekt (I-Effekt).
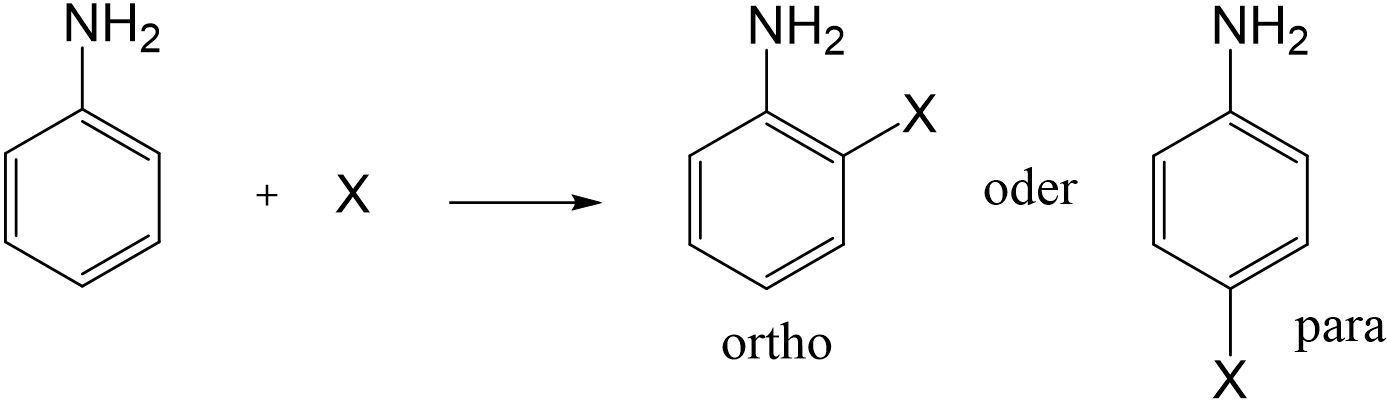
Sie bezeichnet Substitution eines Atoms oder einer Atomgruppe durch ein Elektrophil, einer Atomgruppe, die an einer Position einen Elektronenmangel aufweist. Dieses geht bevorzugt Reaktionen mit elektronenreichen Spezies, beispielsweise mit ungesättigten Kohlenstoffverbindungen und vor allem mit Aromaten ein.
Warum heißt es radikalische Substitution : Was versteht man unter einer radikalischen Substitution Bei der radikalischen Substitution, kurz SR, handelt es sich um eine Substitutionsreaktion – es wird mindestens ein Atom (Wasserstoffatom) in einem Molekül durch ein Anderes (Halogen) ersetzt. Die radikalische Substitution läuft über Radikale.
Was heisst Substitution : Substitution bedeutet Ersatz oder Ersetzung. Ziel der Substitution ist es zunächst, die Folgeerscheinungen der Abhängigkeit zu mindern (Harm Reduction / Überlebenshilfe). Die von der Abhängigkeit Betroffenen sollen gesundheitlich und sozial stabilisiert werden.
Was bedeutet der Begriff Substitution
Substitution beschreibt generell die Ersetzung bzw. den Austausch von Termen, Dingen oder Prozessen. Dies geschieht zum Beispiel in der Prädikatenlogik oder in der Mathematik.

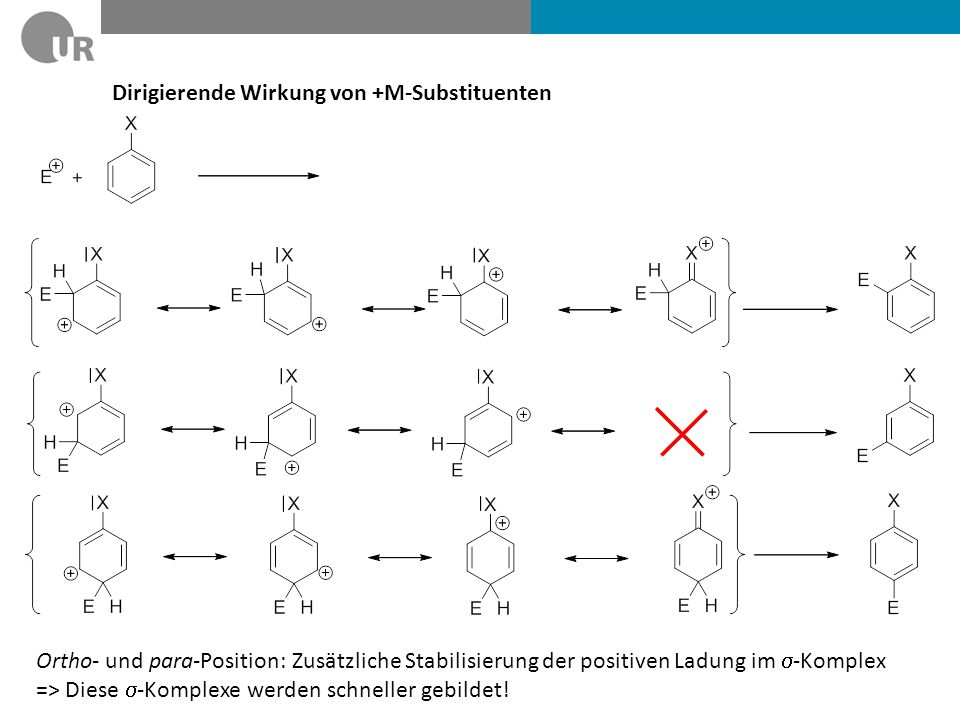
Der M-Effekt ist stärker als der I-Effekt. Ausnahme bilden die Halogene: Zur Überlappung mit den p- Atomorbitalen der Halogene mit den sp2-Hybridorbitalen des Kohlenstoffs stehen nur beim Fluoratom 2p- Orbitale zur Verfügung, beim Chloratom sind es 3p-Orbitale, beim Iodatom sogar 5p-Orbitale.Gleiche Ladungen stoßen sich ab, ungleiche ziehen sich an. Dieses Grundprinzip der Elektrostatik wird durch das sogenannte coulombsche Gesetz beschrieben. Demnach stoßen sich negativ geladene Teilchen wie Elektronen gegenseitig ab.
Was zieht Elektronen an : Die Elektronegativität gibt an, wie stark ein Element innerhalb einer Bindung an den Elektronen zieht. Je höher der Wert, desto stärker zieht der Atomkern eines Atoms Elektronen an sich heran.

![csm_2405-bauerfeind-produktkategoriesseiten-bandagen-ellenbogenbandage-2560x1400_88-1_f91f66009c[1]](https://www.nakajimamegumi.com/wp-content/uploads/2024/06/csm_2405-bauerfeind-produktkategoriesseiten-bandagen-ellenbogenbandage-2560x1400_88-1_f91f66009c1-1024x521-65x65.jpg)
![Ischiasschmerzen[1]](https://www.nakajimamegumi.com/wp-content/uploads/2024/06/Ischiasschmerzen1-1024x640-65x65.jpg)
![csm_blogbeitrag_autoimmunerkrankung_d307ac8b72[1]](https://www.nakajimamegumi.com/wp-content/uploads/2024/06/csm_blogbeitrag_autoimmunerkrankung_d307ac8b721-1024x576-65x65.jpeg)